Kit TIANScriptⅡ RT
ciri-ciri
■ Aktiviti dan kecekapan enzim yang tinggi: Aktiviti transkripase terbalik yang tinggi dan keserasian yang baik dalam eksperimen berikutnya.
■ Julat substrat yang luas: Sesuai untuk semua RNA, terutamanya templat RNA dengan struktur sekunder yang kompleks.
■ Panjang RT panjang: Sintesis helai pertama cDNA boleh mencapai 12 kb.
■ Operasi sederhana: Cukup tambahkan komponen yang diperlukan dalam satu langkah tanpa menambahkan reagen selama operasi.
Permohonan
■ Sintesis helai pertama cDNA.
■ Pembinaan perpustakaan cDNA.
■ RT-PCR satu langkah.
■ Analisis RACE.
Semua produk boleh disesuaikan untuk ODM / OEM. Untuk keterangan,sila klik Perkhidmatan Tersuai (ODM / OEM)
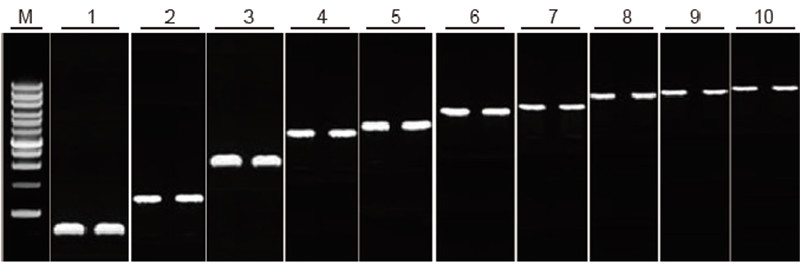 |
Keupayaan transkripsi terbalik TIANScript II RT Kit untuk pecahan panjang yang berbeza Kaedah: Transkripsi terbalik: Rujuk manual arahan Kit TIANScript II RT. Hasil: Gambar gel menunjukkan hasil penguatan 10 gen sasaran dengan panjang yang berbeza setelah transkripsi terbalik 1 μg total RNA. 2 μl produk transkripsi terbalik dimuat setiap jalur. Sistem penguat (PCR): 20 μl; Beban sampel: 5 μl; Penanda: D15000 + 1 kb Tangga DNA; Kepekatan gel: 1%; Keadaan elektroforesis: 6 V / cm, 20 min Diagram setiap lorong: M: Penanda DNA; 1: Panjang produk: 120 bp; 2: Panjang produk: 1 kb; 3: Panjang produk: 2.5 kb; 4: Panjang produk: 3.2 kb; 5: Produk panjang: 4.6 kb; 6: Panjang produk: 6.8 kb; 7: Panjang produk: 7.6 kb; 8: Panjang produk: 8.9 kb; 9: Panjang produk: 10 kb; 10: Panjang produk: 12 kb; |
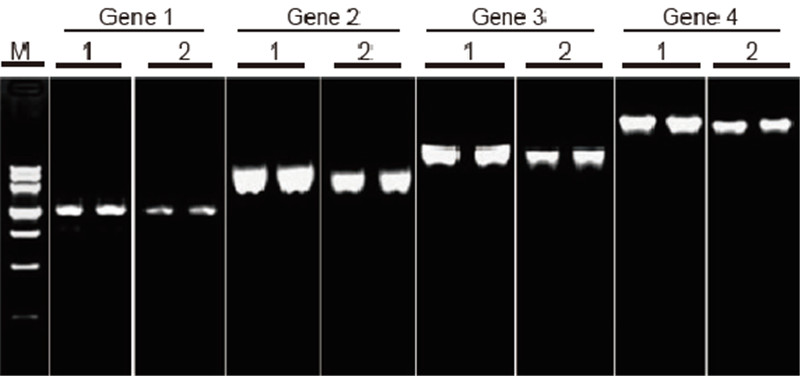 |
Perbandingan kecekapan dan kekhususan TIANScript II RT Kit dan produk dari pembekal lain dalam transkripsi terbalik templat panjang Bahan: Jumlah RNA sel yang melekat pada manusia. Jumlah permulaan RT-PCR: 2 μl produk transkripsi terbalik (50 ng / μl) Kaedah: Transkripsi terbalik: Rujuk manual arahan Kit TIANScript II RT. Hasil: Gambar gel menunjukkan hasil penguatan 6 gen sasaran dengan panjang yang berbeza setelah transkripsi terbalik 1 μg total RNA sel-sel pematuhan manusia menggunakan M-MLV dari Pembekal A dan TIANGEN TIANScript II RT Kit. Sistem penguat (PCR): 20 μl; Beban sampel: 5 μl; Penanda: DNA MarkerIII; Kepekatan gel: 1%; Keadaan elektroforesis: 6 V / cm, 20 min. Diagram setiap lorong: M: Penanda DNA; 1: Hasil pengukuhan cDNA terbalik ditranskrip menggunakan TIANScriptII RT Kit; 2. Hasil pengukuhan cDNA terbalik ditranskrip menggunakan produk yang relevan dari Pembekal A. Panjang gen 1 produk ialah 1.3 kb; Panjang produk gen 2 ialah 3.0kb; Panjang produk gen 3 ialah 5.0 kb; Panjang produk gen 4 ialah 7.5 kb. |
RNA A-1 terdegradasi
——Menyucikan RNA berkualiti tinggi tanpa pencemaran. Bahan dari mana RNA diekstrak semestinya segar untuk mencegah penurunan RNA. Analisis integriti RNA pada gel denaturasi sebelum tindak balas RT. Selepas pengekstrakan RNA, ia harus disimpan dalam formamide 100%. Sekiranya penghambat RNase digunakan, suhu pemanasan harus <45 ° C, dan pH harus kurang dari 8.0, jika tidak, perencat akan melepaskan semua RNase yang terikat. Selain itu, perencat RNase harus ditambahkan dalam larutan yang mengandungi T 0,8 mM DTT.
A-2 RNA mengandungi perencat tindak balas transkripsi terbalik
—— Inhibitor transkripsi terbalik termasuk SDS, EDTA, gliserol, natrium pirofosfat, spermidin, formamide, garam guanidin, dll. Campurkan RNA kawalan dengan sampel, dan bandingkan hasilnya dengan reaksi RNA kawalan untuk memeriksa sama ada terdapat perencat. Basuh pemendakan RNA dengan 70% (v / v) etanol untuk menghilangkan perencat.
A-3 Penyepuhlindapan primer yang tidak mencukupi digunakan untuk mensintesis helai pertama cDNA
—— Tentukan bahawa suhu penyepuhlindapan sesuai untuk primer yang digunakan dalam eksperimen. Untuk heksamer rawak, disarankan untuk mengekalkan suhu pada 25 ° C selama 10 minit sebelum mencapai suhu tindak balas. Untuk primer khusus gen (GSP), cuba GSP lain, atau beralih ke oligo (dT) atau hexamer rawak.
A-4 Sejumlah kecil RNA permulaan
——Meningkatkan jumlah RNA. Untuk sampel RNA kurang dari 50 ng, 0.1 μg hingga 0.5 μg asetil BSA dapat digunakan dalam sintesis helai cDNA pertama
A-5 Urutan sasaran tidak dinyatakan dalam tisu yang dianalisis.
——Cuba tisu lain.
Reaksi PCR A-6 gagal
——Untuk RT-PCR dua langkah, templat cDNA dalam langkah PCR tidak boleh melebihi 1/5 dari volume tindak balas.
A-1 Penyepuhlindapan primer dan templat yang tidak spesifik
Primer 3'-end tidak boleh mengandungi 2-3 dG atau dC. Gunakan primer khusus gen dalam sintesis helai pertama dan bukan primer rawak atau oligo (dT). Gunakan suhu penyepuhlindapan yang lebih tinggi dalam beberapa kitaran pertama, dan kemudian suhu penyepuhlindapan yang lebih rendah. Gunakan polimerase DNA Taq permulaan panas untuk PCR untuk meningkatkan kekhususan tindak balas.
A-2 Reka bentuk primer khusus gen yang lemah
- Ikuti prinsip yang sama untuk reka bentuk primer penguat.
RNA A-3 tercemar dengan DNA genom
—— Rawat RNA dengan PCN kelas PCR I. Siapkan reaksi kawalan tanpa transkripsi terbalik untuk mengesan pencemaran DNA.
A-4 Pembentukan dimer primer
--— Reka bentuk primer tanpa urutan pelengkap pada akhir 3 '.
A-5 Mg terlalu tinggi2+ kepekatan
—— Mengoptimumkan Mg2+ kepekatan untuk setiap templat dan kombinasi primer
A-6 tercemar dengan DNA asing
——Gunakan petua tahan aerosol dan enzim UDG.
A-1 Kandungan produk helai pertama terlalu tinggi
—— Kurangkan jumlah produk helai pertama dalam langkah reaksi PCR konvensional.
A-2 Jumlah primer yang terlalu tinggi dalam tindak balas PCR
——Mengurangkan input primer.
A-3 Terlalu banyak kitaran
—— Mengoptimumkan keadaan reaksi PCR dan mengurangkan bilangan kitaran PCR.
A-4 Suhu penyepuhlindapan yang terlalu rendah
——Meningkatkan suhu penyepuhlindapan untuk mengelakkan permulaan dan pemanjangan yang tidak spesifik.
A-5 Penguatan serpihan oligonukleotida yang tidak spesifik yang dihasilkan oleh degradasi DNA DNase - Ekstrak RNA berkualiti tinggi untuk mengelakkan pencemaran DNA.
RT-PCR adalah membalikkan transkripsi RNA ke dalam cDNA, dan kemudian menggunakan cDNA yang ditranskripsikan terbalik sebagai templat reaksi PCR untuk memperkuat fragmen sasaran. Pilih sama ada primer rawak, Oligo dT dan primer khusus gen mengikut keadaan spesifik eksperimen. Semua primer di atas boleh digunakan untuk mRNA sel eukariotik pendek tanpa struktur jepit rambut.
Primer rawak: Sesuai untuk RNA panjang dengan struktur jepit rambut, serta semua jenis RNA seperti rRNA, mRNA, tRNA, dan lain-lain. Ia digunakan terutamanya untuk reaksi RT-PCR satu templat.
Oligo dT: Sesuai untuk RNA dengan ekor PolyA (prokariotik RNA, eukariotik Oligo dT rRNA dan tRNA tidak mempunyai ekor PolyA). Oleh kerana Oligo dT terikat pada ekor PolyA, kualiti sampel RNA diperlukan tinggi, dan bahkan sebilangan kecil degradasi akan sangat mengurangkan jumlah sintesis cDNA panjang penuh.
Primer khusus gen: Pelengkap urutan templat, sesuai untuk situasi di mana urutan sasaran diketahui.
Terdapat dua cara:
1. Kaedah rujukan dalaman: Secara teori, cDNA adalah serpihan DNA dengan panjang yang berbeza, jadi hasil elektroforesis adalah smear. Sekiranya kelimpahan RNA rendah, tidak ada produk yang akan ditunjukkan dalam elektroforesis, tetapi ini tidak bermaksud tidak ada produk yang akan diperkuat oleh PCR. Secara umum, rujukan dalaman dapat digunakan untuk mengesan cDNA. Sekiranya rujukan dalaman mempunyai hasil, kualiti cDNA pada dasarnya dapat dijamin (dalam beberapa kes, jika fragmen gen sasaran terlalu panjang, mungkin ada pengecualian).
2. Sekiranya terdapat gen yang diketahui yang diperkuat oleh templat ini, ia dapat disahkan oleh primer gen ini. Penguatan rujukan dalaman tidak semestinya bermaksud bahawa tidak ada masalah dengan cDNA. Oleh kerana rujukan dalaman mempunyai kelimpahan yang tinggi dalam cDNA, mudah dikuatkan. Sekiranya cDNA sebahagiannya terdegradasi kerana pelbagai sebab, dari perspektif kebarangkalian, hasil PCR gen sasaran berlimpah rendah akan sangat terjejas. Walaupun rujukan dalaman masih banyak, amplifikasi mungkin tidak akan terjejas.
Penurunan sebahagian RNA. Mengesan integriti dan membersihkan RNA
Kandungan RNA dari pelbagai spesies mungkin berbeza, tetapi secara umum, jumlah RNA yang diekstrak harus mengandungi dua jalur 28S dan 18S yang jelas dalam elektroforesis gel, dan kecerahan jalur sebelumnya harus dua kali lebih tinggi daripada yang terakhir. Jalur 5S menunjukkan bahawa RNA telah menurun, dan kecerahannya sebanding dengan tahap penurunan. Penguatan rujukan dalaman yang berjaya tidak bermaksud tidak ada masalah dengan RNA, kerana rujukan dalamannya banyak, RNA dapat diperkuat selagi degradasi tidak parah. OD260/ OD280nisbah RNA tulen yang diukur dengan spektrofotometer hendaklah antara 1.9 dan 2.1. Sebilangan kecil kekotoran protein dalam RNA akan mengurangkan nisbah. Selagi nilainya tidak terlalu rendah, RT tidak akan terjejas. Yang paling penting bagi RT adalah integriti RNA.
Peluasan gen rujukan dalaman hanya dapat menunjukkan bahawa RT telah berjaya, tetapi tidak semestinya berkaitan dengan kualiti helai cDNA. Kerana serpihan rujukan dalaman umumnya berukuran kecil dan tinggi ekspresi, lebih mudah berjaya dalam transkripsi terbalik. Walau bagaimanapun, ukuran dan ekspresi gen sasaran berbeza dari gen ke gen. Kualiti cDNA tidak dapat dinilai hanya dengan rujukan dalaman terutama untuk serpihan sasaran lebih dari 2 kb.
Beberapa sampel mempunyai struktur sekunder yang kompleks, atau mempunyai kandungan GC yang kaya, atau berharga dengan kelimpahan yang rendah. Dalam kes ini, transkripase terbalik yang sesuai harus dipilih sesuai dengan ukuran serpihan sasaran dan sampel. Untuk templat RNA dengan kandungan GC tinggi dan struktur sekunder kompleks, sukar untuk membuka struktur sekunder pada suhu rendah, atau dengan transkripase terbalik biasa. Untuk templat ini, Quant Reverse Transcriptase dapat dipilih, kerana prestasi transkripsi terbalik jelas lebih baik daripada transkripase terbalik siri M-MLV, yang dapat membalikkan transkripsi pelbagai templat RNA dengan cekap dan mentranskripsikan RNA ke helai pertama cDNA hingga tahap maksimum. Apabila menggunakan kit transkripase terbalik am, sistem 20 μl hanya dapat membalikkan transkrip 1 μg jumlah RNA secara berkesan. Perhatikan kapasiti maksimum RT kit. Sekiranya templat ditambahkan secara berlebihan, transkripsi terbalik akan menggemari RNA dengan jumlah yang banyak. Oleh itu, lebih baik tidak melebihi kapasiti maksimum sistem.
A-1 Tentukan apakah RNA mengalami penurunan teruk dan jika RT berjaya
Secara umum, alasan kegagalan penguatan rujukan dalaman sering disebabkan oleh penurunan RNA yang serius. Sebab lain yang mungkin adalah kegagalan transkripsi terbalik. Rujukan dalaman tidak dapat digunakan sebagai standar untuk menilai kualitas untaian tunggal cDNA, tetapi dapat digunakan sebagai standar untuk menilai apakah transkripsi terbalik berhasil jika tidak ada masalah dengan kualiti RNA. Perkara yang paling penting dalam proses transkripsi terbalik adalah mengekalkan suhu tetap dan sistem reaksi tetap untuk meningkatkan kecekapan tindak balas.
A-2 Tentukan apakah primer untuk memperkuat gen rujukan dalaman boleh dipercayai dan jika ada masalah dengan reagen yang digunakan dalam PCR.
Untuk pengukuran relatif, RNA mesti diukur sebelum transkripsi terbalik, yang juga diperlukan dalam banyak kit transkripsi terbalik, misalnya, mengukur input RNA sebagai 1 μg. Oleh kerana cDNA yang ditranskripsikan terbalik adalah larutan campuran, termasuk RNA, oligo dT, enzim, dNTP, dan bahkan sedikit sisa DNA, penyimpangan akan terjadi, jadi mustahil untuk mengukur cDNA secara tepat. Oleh itu, pengukuran RNA adalah perlu. Memandangkan kecekapan transkripsi terbalik adalah sama di antara sampel yang berbeza, jumlah cDNA yang diperoleh harus sama, dan analisis kuantitatif dapat menunjukkan perbandingan tahap ekspresi gen yang berlainan dalam jumlah total RNA yang sama. Semasa melakukan PCR kuantitatif pendarfluor relatif, cDNA kuantitatif mungkin tidak diperlukan setelah transkripsi terbalik kerana gen rujukan dalaman dapat bertindak sebagai rujukan.
Ini terutama berkaitan dengan gen, dan transkripsi pecahan panjang tidak dapat dilaksanakan untuk kebanyakan gen. Pertama, kecekapan transkripsi terbalik jauh lebih rendah daripada PCR. Kedua, wilayah kaya GC dan struktur sekunder banyak gen menyekat transkripsi terbalik dan PCR. Akhirnya, kesetiaan dan kecekapan PCR sukar dijamin pada masa yang sama. Dalam proses transkripsi terbalik, tidak ada yang dapat menjamin mendapatkan fragmen panjang untuk gen salinan rendah, terutama menggunakan oligo dT. Bagi UTR 5 'dengan lebih banyak GC, lebih sukar lagi. Oleh itu, masih merupakan kaedah yang munasabah untuk membalikkan transkrip dengan primer rawak, mencari tapak pembelahan semula jadi dalam serpihan sasaran, memperkuat mengikut segmen, dan kemudian melakukan penghadaman dan ligasi sekatan. Secara umum, sukar untuk secara langsung memperkuat serpihan yang lebih besar daripada 2 kb, tetapi tidak selalu mustahil untuk diperoleh: 1. Pertama sekali, menjamin integriti RNA / mRNA, dan pengekstrakan TRIZOL lebih disukai. 2.M-MLV RT-PCR kit boleh digunakan secara langsung. Panjangkan masa penyepuhlindapan dan tingkatkan bilangan kitaran dalam proses penguat dengan betul. Sebagai alternatif, PCR bersarang dapat digunakan, atau melakukan satu atau dua reaksi terlebih dahulu dengan denaturasi dan masa perpanjangan yang tepat sebelum penguatan PCR normal, yang dapat membantu memperpanjang pecahan. Perhatikan kesetiaan polimerase. 3. Long Taq boleh digunakan dalam PCR untuk mendapatkan hasil yang ideal. 4. Untuk aplikasi ekspresi protein, polimerase kesetiaan tinggi harus digunakan.
Terdapat dua jenis transkripase terbalik yang ditawarkan oleh TIANGEN: Quant / King RTase dan TIANScript M-MLV. Perbezaan utama antara mereka adalah jumlah templat input. Quant adalah transkripase terbalik yang unik, yang berbeza dengan M-MLV yang biasa digunakan yang berasal dari virus leukemia Moloney murine. Quant adalah transkripase terbalik kecekapan tinggi baru yang dikombinasikan semula oleh teknik Escherichia coli. Quant sesuai untuk menguatkan 50 ng-2 μg RNA dengan aktiviti transkrip terbalik yang tinggi dan hasil yang tinggi. Berbanding dengan MMLV atau AMV biasa, ciri terbesar Quant adalah ia mempunyai pertalian yang sangat kuat dengan templat RNA dan dapat membalikkan templat kompleks transkrip tanpa denaturasi suhu tinggi. Untuk templat dengan kandungan GC yang lebih tinggi, kecekapan terbalik lebih tinggi. Walau bagaimanapun, transkripase terbalik ini mempunyai aktiviti RNase H, yang mungkin mempengaruhi panjang produk cDNA (sesuai untuk templat <4,5 kb). Untuk transkripsi terbalik konvensional, transkripase terbalik TIANScript MMLV disyorkan. RTase ini adalah enzim yang diubahsuai dengan aktiviti RNase H yang sangat lemah, yang sesuai untuk sintesis cDNA yang panjang (> 5 kb).
Transkripsi terbalik satu langkah dan penguatan PCR diselesaikan dalam tiub yang sama tanpa membuka penutup tiub antara sintesis dan penguat cDNA, yang membantu mengurangkan pencemaran. Oleh kerana semua sampel cDNA yang diperoleh digunakan untuk penguatan, kepekaannya lebih tinggi, dengan minimum 0,01 pg dari total RNA. Untuk RTPCR satu langkah yang berjaya, primer khusus gen biasanya digunakan untuk memulakan sintesis cDNA. Kaedah dua langkah, iaitu transkripsi terbalik dan penguatan PCR dilakukan dalam dua langkah. Transkripsi terbalik pertama kali dilakukan dari templat RNA untuk mendapatkan cDNA, dan cDNA yang diperoleh dikenakan satu atau lebih reaksi PCR yang berbeza. Kaedah dua langkah boleh menggunakan oligo (dT) atau primer rawak untuk memandu sintesis helai pertama cDNA, dan dapat membalikkan transkripsi semua maklumat mRNA dari sampel tertentu.
Kategori produk
KENAPA PILIH KAMI
Sejak didirikan, kilang kami telah mengembangkan produk bertaraf dunia pertama dengan mematuhi prinsip
berkualiti terlebih dahulu. Produk kami telah mendapat reputasi yang sangat baik dalam industri dan sangat berharga di kalangan pelanggan baru dan lama ..








